
Back پریودیک اسید AZB Àcid periòdic Catalan Kyselina jodistá Czech Periodsäure German Periodic acid English Ácido peryódico Spanish پریودیک اسید Persian Perjodihappo Finnish Acide periodique French Perjódsav Hungarian
| Perjodata acido | |||||
| |||||
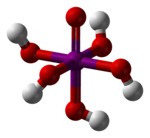
| Kemia strukturo de la Orto-perjodata acido aŭ H5IO6 | |||||
| |||||
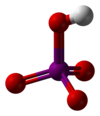
| Kemia strukturo de la Meta-perjodata acido aŭ HIO4 | |||||
| GHS-piktogramoj por brulivaj kaj korodaj substancoj | |||||
| Kemia formulo |
| ||||
| CAS-numero-kodo | 10450-60-9 | ||||
| ChemSpider kodo | |||||
| PubChem-kodo | |||||
| Fizikaj proprecoj | |||||
| Aspekto | Senkoloraj kristaloj | ||||
| Molmaso |
| ||||
| Smiles |
| ||||
| Denseco | 1.4 kg/m3 g/cm3 (ortoperiodata acido) | ||||
| Fandopunkto | 128.5 °C (263.3 ℉; 401.6 K)[1] | ||||
| Solvebleco |
| ||||
| Sekurecaj Indikoj | |||||
| Risko | R8 R23 R24 R25 R34 R41 | ||||
| Sekureco | S26, S36/37/39, S45 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS etikedigo de kemiaĵoj[1] | |||||
| GHS Damaĝo-piktogramo |
| ||||
| GHS Signalvorto | Damaĝo | ||||
| GHS Deklaroj pri damaĝoj | H272, H314 | ||||
| GHS Deklaroj pri antaŭgardoj | P210, P221, P260, P264, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P363, P405, P501 | ||||
(25 °C kaj 100 kPa) | |||||
Perjodata acido, Perjodato de hidrogeno estas oksoacido de jodo kun plej alta oksidiĝa nombro +7. Kiel ĉiuj perjodatoj, ĝi ekzisteblas laŭ du formoj: ortoperjoda acido aŭ H5IO6 kun oksidiĝa nombro kaj metaperjodata acido aŭ HIO4. Perjodata acido estis malkovrita en 1833 de Heinrich Gustav Magnus (1802-1870) kaj Carl Friedrich Ammermüller, patro de samnoma kuracisto Friedrich Ammermüller (1809-1898).
Perjodata acido posedas acidajn proprecojn similajn al tiuj de la perklorata acido. Ĝia solvaĵo eblas boli sen malkomponiĝo, kaj sub vaporigo la acido estigas acidajn kristalojn, kiuj estas tre stabilaj sub aera ekspozicio. Kiam varmigita supera ol 212 °C, perjodata acido perdas oksigenon kaj jodata acido restas. Tiamaniere ke perjodata acido estas pli facila malkomponiĝi ol jodata acido[2].
- ↑ Αlfa Aesar[rompita ligilo]
- ↑ Elements of Chemistry Including in the History of the Imponderables and the ..., Edward Turner





